轻松准确分剂量 | 助力儿童给药-螺内酯
将乐宜配和螺内酯片通过一定的方法配制成混悬液,对该混悬液的含量,有关物质,溶出度和生物等效性进行评估。
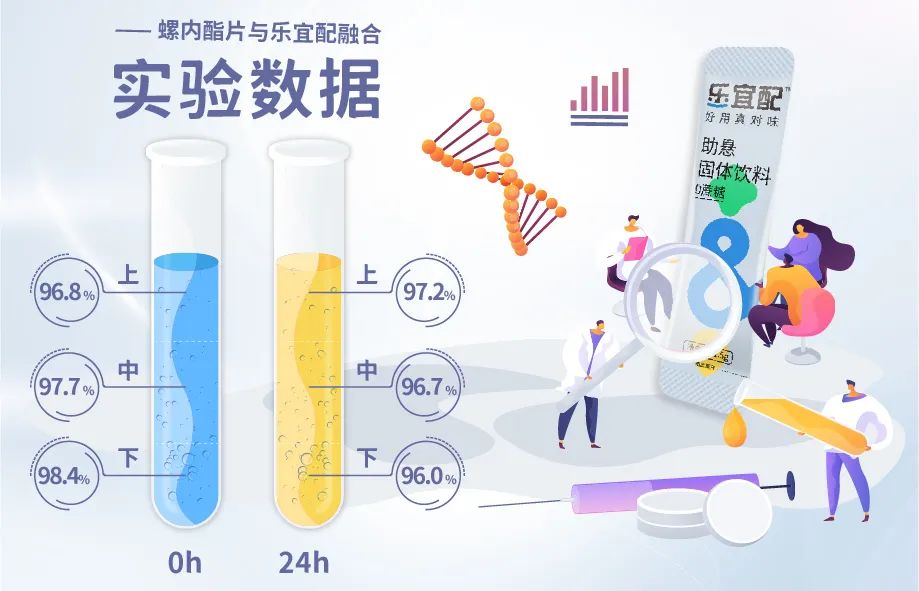
室温储存24h,质量稳定,符合中国药典片剂质量标准,体外溶出曲线考察表明,该混悬液在10分钟溶出度超过螺内酯片20%,因此乐宜配调制螺内酯混悬液的生物利用度可能比片剂高。
考虑到螺内酯临配混悬液(Spironolactone Compounded Oral Suspension)在美国使用多年,25mg螺内酯混悬液(Carospir)的生物利用度比25mg螺内酯片仅高约15%,更低剂量 (< 20mg) 的螺内酯调制混悬液和螺内酯片的生物利用度会相差更小,
因此使用乐宜配调制螺内酯混悬剂
分剂量后安全性可以保障。

螺内酯属于利尿药,用于治疗水肿性疾病和原发性醛固酮增多症,作为治疗高血压的辅助药物及低钾血症的预防。
1960年1月21日,螺内酯片由辉瑞公司开发在美国上市,规格为25mg、50mg和100mg,2017年8月4日,螺内酯混悬剂(Carospir)在美国上市,规格为5mg/ml。国内通过一致性评价仅有螺内酯片,规格为20mg、25mg和100mg,无螺内酯混悬剂上市。
螺内酯片在医院的分剂量应用较多,
但是分剂量后的质量合格率低。
如何有效实现螺内酯片的准确分剂量是医药界急需解决的问题。
鉴于以上现存问题,我们以临床需求为出发点,旨在解决目前儿童用药困难,开发了乐宜配产品用于调制口服固体制剂,并以CDE在2020年12月31日发布的《儿童用药(化学药品)药学开发指导原则》为依据,考察了乐宜配调制螺内酯混悬液的质量研究和生物等效性风险评估。
01
/
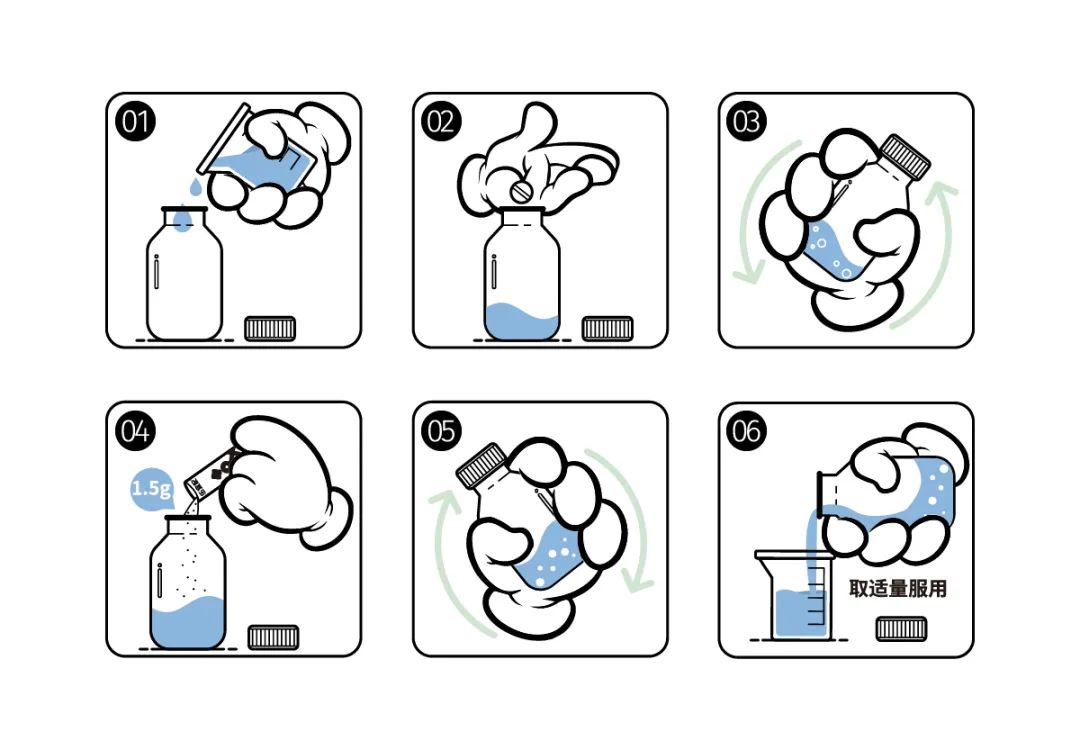
调制螺内酯
混悬液的制备
02
/
调制螺内酯
混悬液的质量研究

含量:调制螺内酯混悬液室温储存0h~24h,含量均在标示量的95.0%~105.0%,且与配制混悬液前的片剂含量相似,满足市售片剂的含量标准,上、中、下含量的相对标准偏差小于5.0%,混悬剂含量均匀度合格。

有关物质:调制螺内酯混悬液室温储存0h~24h,最大单杂均小于1.0%,总杂小于1.0%,坎利酮峰面积在0h和24h未见明显增长,满足市售片剂的有关物质标准。

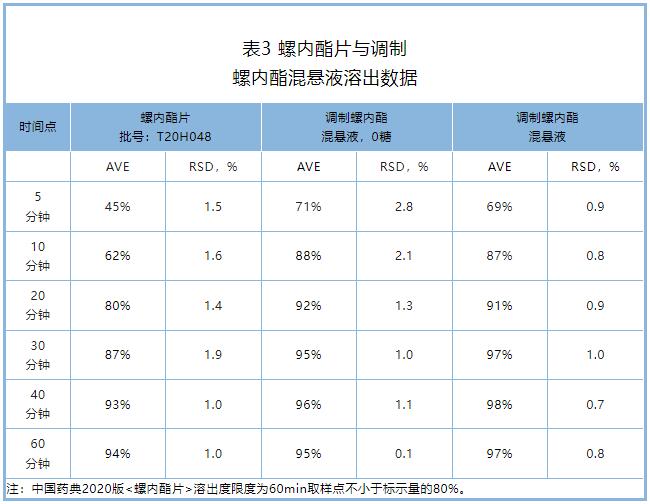
溶出度:调制螺内酯混悬液在10分钟的溶出度比螺内酯片高20%以上,两者溶出曲线相似因子f2小于50,根据溶出曲线比较指导原则,调制螺内酯混悬液与螺内酯片不具有相似性,
但调制螺内酯混悬液和螺内酯片60分钟放行点(Q)均大于80%,满足2020年版《中国药典》片剂溶出度标准。
03
/
调制螺内酯混悬液
生物等效性风险评估

螺内酯属于BCS II类,水中溶解度非常低,为28ug/ml,螺内酯体内吸收迅速但不完全,吸收程度取决于螺内酯的粒径和处方,生物利用度约为60%~90%,进食可提高生物利用度,所以螺内酯要和液体或者食物一起服用促进吸收。
CMP公司开展了两个生物等效性研究,一个是比较25mg螺内酯片和螺内酯口服混悬液,另一个是比较100mg螺内酯片和螺内酯混悬液,结果表明,25mg混悬液的生物利用度比25mg螺内酯片高约15%,100mg混悬液生物利用度比100mg螺内酯片高约35%。
调制螺内酯混悬液和螺内酯片(规格:20mg)体外溶出显示,混悬液在10分钟的溶出度比螺内酯片高20%以上,因此调制螺内酯混悬液的生物利用度可能高于螺内酯片。

考虑到螺内酯临配混悬液(Spironolactone Compounded Oral Suspension)在美国使用多年,25mg螺内酯混悬液(Carospir)的生物利用度比25mg螺内酯片仅高约15%,更低剂量 (< 20mg) 的螺内酯混悬液和螺内酯片的生物利用度会相差更小,
使用乐宜配调制螺内酯混悬剂
分剂量后安全性可以保障。
04
/
小结

本文结果显示,乐宜配调制螺内酯混悬液,含量均匀,室温储存24h质量稳定,乐宜配调制螺内酯混悬液在临用前由患者家属自行调制,从配制液体中取部分服用,可以达到灵活调整剂量的目的,又可避免药物降解,具有很好的安全性,有效性和方便性。
用乐宜配调制螺内酯混悬液
可准确的对螺内酯片进行分剂量
药学研究符合《儿童用药(化学药品)药学开发指导原则》的要求,解决了螺内酯片分剂量的难题,值得应用推广。
