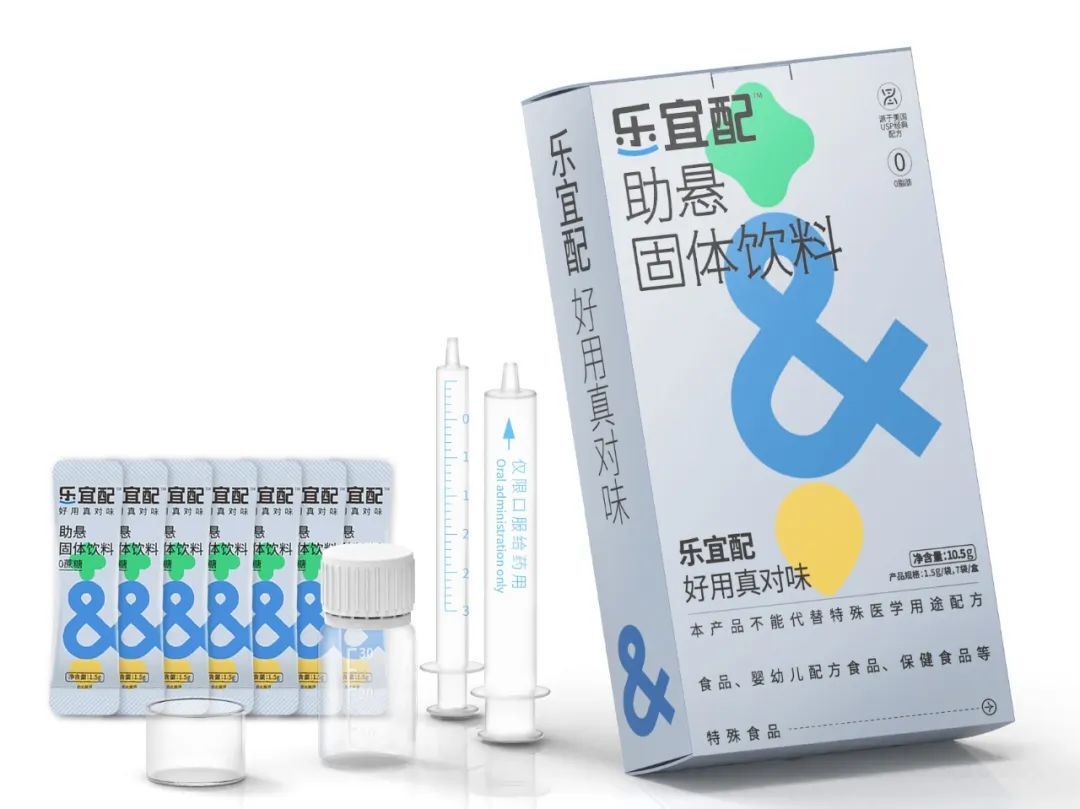
轻松准确分剂量 | 助力儿童给药-卡托普利
将乐宜配和卡托普利片通过一定的方法配制成混悬液,对该混悬液的含量,有关物质,溶出度和生物等效性进行评估。
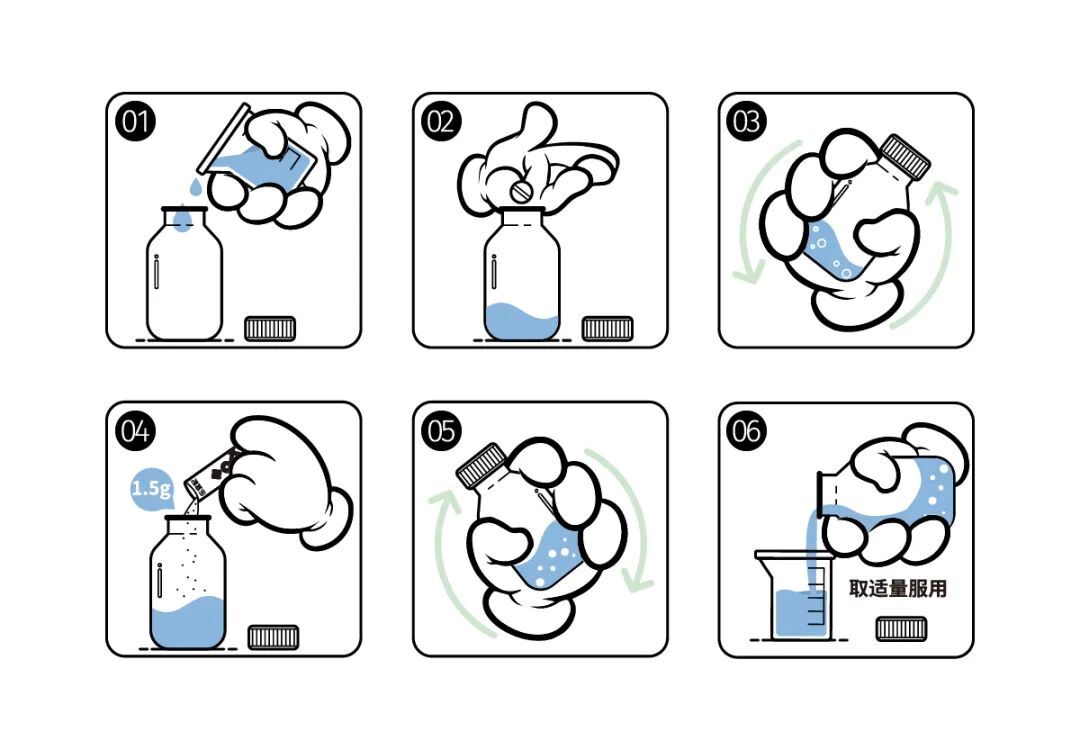
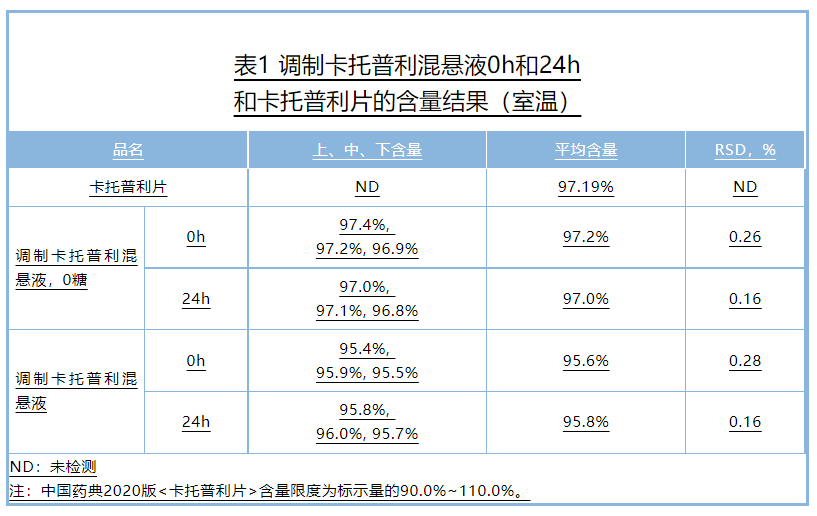
乐宜配产品与卡托普利片配制混悬液后,上,中,下含量一致,可以准确的分剂量;(详见下图示意)

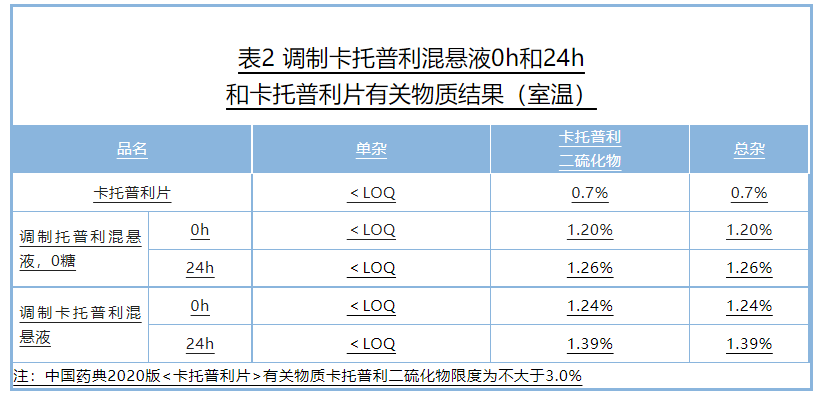
室温避光储存24h,质量稳定,符合中国药典片剂质量标准;同时体外溶出曲线考察表明,该混悬液与卡托普利片有相似的溶出曲线,根据对卡托普利体内吸收特性的评估,可以认为调制卡托普利混悬液与卡托普利具有生物等效性,
该项研究解决了卡托普利片
用药的分剂量难题,
对儿童用药具有现实意义。

卡托普利片于1981年由百时美施贵宝公司开发,首先在FDA上市,适用于治疗各种类型高血压,同时适用于其它降压治疗无效的儿科病人,给药剂量须遵循个体化原则,按疗效而予以调整。
目前传统调剂量方法存在着分剂量困难、分剂量不准确、微生物污染、药品品质及安全性问题等弊端,以及药师存在职业暴露风险,如在劈片、片剂磨粉或打开胶囊中,药师均有可能接触或吸入药品粉末,从而造成职业暴露。
如何有效实现卡托普利片的准确分剂量是医药界急需解决的问题。
01
/
调制卡托普利
混悬液的制备
02
/
调制卡托普利
混悬液的质量研究

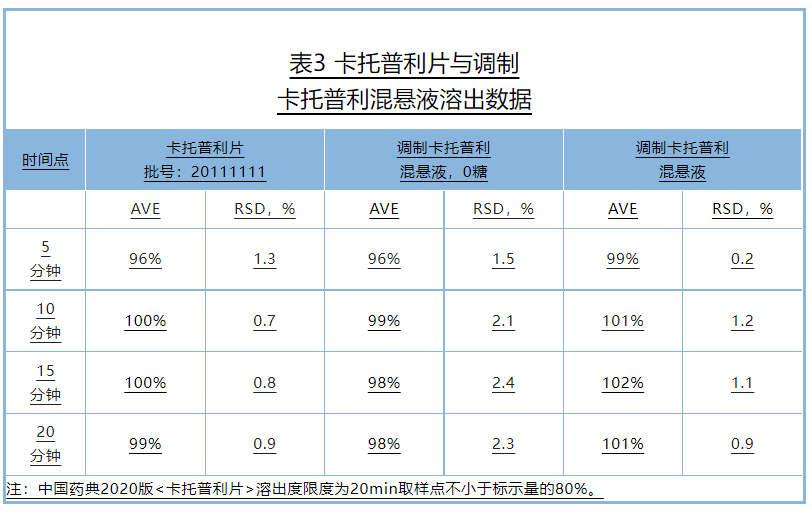
溶出度:调制卡托普利混悬液与卡托普利片溶出度在5分钟均大于85%,因此,根据溶出曲线比较指导原则,调制卡托普利混悬液与卡托普利片具有相似的溶出曲线(表3);
且20分钟放行点(Q)大于80%,满足2020年版《中国药典》片剂溶出度标准。
03
/
调制卡托普利混悬液
生物等效风险评估

卡托普利在pH1.2、pH4.0、pH6.8和水中的溶解度分别为76mg/ml、83mg/ml、81mg/ml和81mg/ml,生理pH环境中溶解度较好,卡托普利生物药剂学分类列为BCSIII类,属于高溶解,低渗透药物,因此低渗是卡托普利吸收的限速步骤,卡托普利的吸收窗较窄,限制了小肠其它部位的吸收,主要吸收部位在近端小肠。
由于卡托普利在胃环境中全部溶解,
进而经过小肠上端吸收,
溶解度不是影响吸收的限速步骤。
Abdalrb G A等人考察了4种不同处方和参比制剂体内外相关性评估,发现体外(溶出方法:篮法,900ml,0.01N盐酸溶液,50rpm)15min溶出度大于85%,体内四种处方和参比制剂生物等效。
进食生物利用度降低35%~55%,可能因为食物与药物形成二硫化物,不能被吸收,或者胃环境的pH升高,促进卡托普利的电离,降低吸收,因此说明书推荐空腹给药。

乐宜配所使用辅料在食品和药品中广泛应用,不含有山梨醇,甘露醇,聚乙二醇等影响药物吸收的辅料,乐宜配调制卡托普利混悬液和卡托普利片在胃中均处于溶解状态。
综合评价,可以认为
乐宜配调制卡托普利混悬液
与卡托普利片具有生物等效性。
04
/
小结
本文结果显示,乐宜配调制卡托普利混悬液,含量均匀,室温避光储存24h质量稳定,体外溶出曲线与片剂相似,根据对卡托普利体内吸收特性的评估,可以认为调制卡托普利混悬液和卡托普利片具有生物等效性。

用乐宜配调制卡托普利混悬液
可准确的对卡托普利片进行分剂量
药学研究符合《儿童用药(化学药品)药学开发指导原则》的要求,解决了卡托普利片分剂量的难题,值得应用推广。
