轻松准确分剂量 | 助力儿童给药-氢氯噻嗪
将乐宜配和氢氯噻嗪片通过一定的方法调制成混悬液,对该混悬液的含量,有关物质,溶出度和生物等效性进行评估。
乐宜配产品与氢氯噻嗪片配制混悬液后,上,中,下含量一致,可以准确的分剂量,最低分剂量为1/25;(详见下图示意)
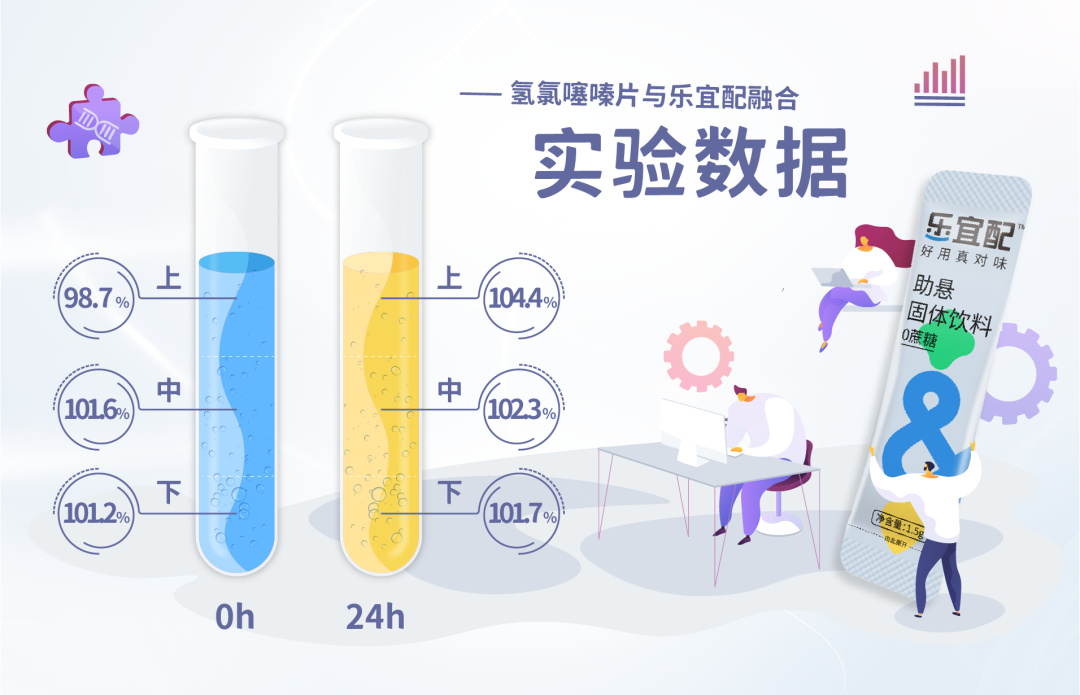
室温放置8h或冷藏储存24h,质量稳定,符合中国药典片剂质量标准,同时体外溶出曲线考察表明,该混悬液与氢氯噻嗪片有相似的溶出曲线,根据对氢氯噻嗪体内吸收特性的评估,可以认为调制氢氯噻嗪混悬液与氢氯噻嗪片具有生物等效性。
该项研究解决了氢氯噻嗪片
用药的分剂量难题,
对儿童用药具有现实意义。
![16576938081348704132.jpg 640[1].jpg](http://www.liquidmateez.com/upload/at/image/20220713/16576938081348704132.jpg)
氢氯噻嗪自1957年问世以来,已有60多年的历史,氢氯噻嗪片有利尿和降压作用。
小儿口服常用量为每日按体重1mg/kg~2mg/kg 或按体表面积30~60mg·m⁻²,分1次~2次服用,并按疗效调整剂量,小于6个月的婴儿剂量可达每日3mg/kg,然而,市售氢氯噻嗪片仅有6.25mg、10mg和25mg,因此无法根据体重进行剂量调整,由于氢氯噻嗪的低溶解度和酸碱不稳定性,无氢氯噻嗪溶液剂或混悬剂等液体剂型上市。
氢氯噻嗪片大多不良反应与剂量和疗程有关,会造成低钾血症、低钠血症、高糖血症、高尿酸血症等。
![16576938271236268D4F.jpg 640[1].jpg](http://www.liquidmateez.com/upload/at/image/20220713/16576938271236268D4F.jpg)
目前氢氯噻嗪传统调剂量方法存在着分剂量困难、分剂量不准确、微生物污染、药品品质及安全性问题等弊端,如何有效实现氢氯噻嗪片的准确分剂量是医药界急需解决的问题。
鉴于以上现存问题,我们以临床需求为出发点,旨在解决目前儿童用药困难,开发了乐宜配产品用于调制口服固体制剂,并以CDE在2020年12月31日发布的《儿童用药(化学药品)药学开发指导原则》为依据,考察了乐宜配调制氢氯噻嗪混悬剂的质量研究和生物等效性风险评估。
01
/
调制氢氯噻嗪
混悬剂的制备
![1657693847469046D863.jpg 640[2].jpg](http://www.liquidmateez.com/upload/at/image/20220713/1657693847469046D863.jpg)
向30ml的PET瓶中加入24ml水,加入1片氢氯噻嗪片(规格:25mg),振摇至完全崩解,摇匀,加入乐宜配1.5g,振摇30s至均匀分散(加入乐宜配后,溶液体积溶胀至约25ml )得到1mg/ml调制氢氯噻嗪混悬液。
02
/
调制氢氯噻嗪
混悬剂的质量研究
![16576938634295001A3F.jpg 640[1].jpg](http://www.liquidmateez.com/upload/at/image/20220713/16576938634295001A3F.jpg)
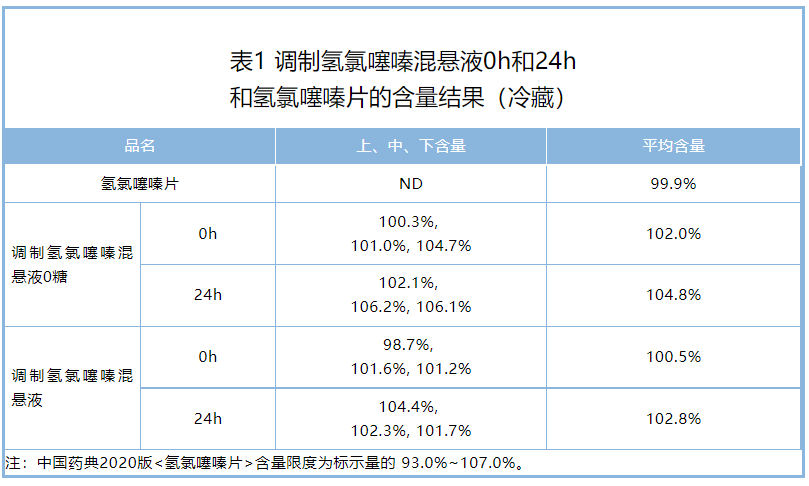
含量:调制氢氯噻嗪混悬液冰箱冷藏储存0h~24h,含量均在标示量的93.0%~107.0%,且与配制混悬液前的片剂含量相似,满足市售片剂的含量标准,上、中、下含量的相对标准偏差小于5.0%,混悬剂含量均匀度合格(表1) 。
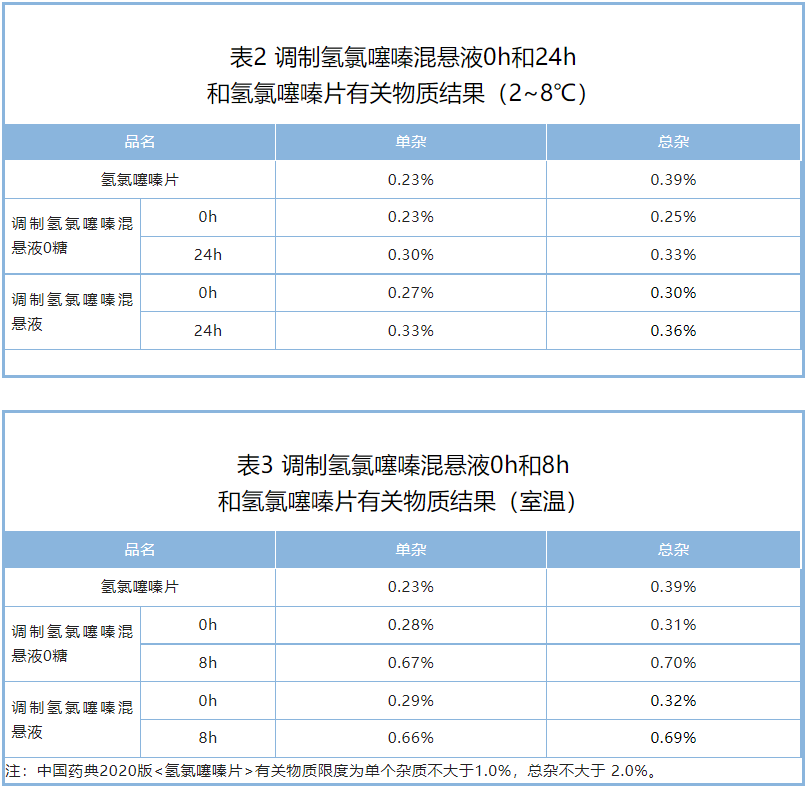
有关物质:调制氢氯噻嗪混悬液室温储存0h~8h,冷藏储存0h~24h,最大单杂均小于1.0%,总杂小于2.0%,满足市售片剂的有关物质标准(表2, 表3)。
溶出度:调制氢氯噻嗪混悬液与氢氯噻嗪片溶出度在10分钟均大于85% (表4)。
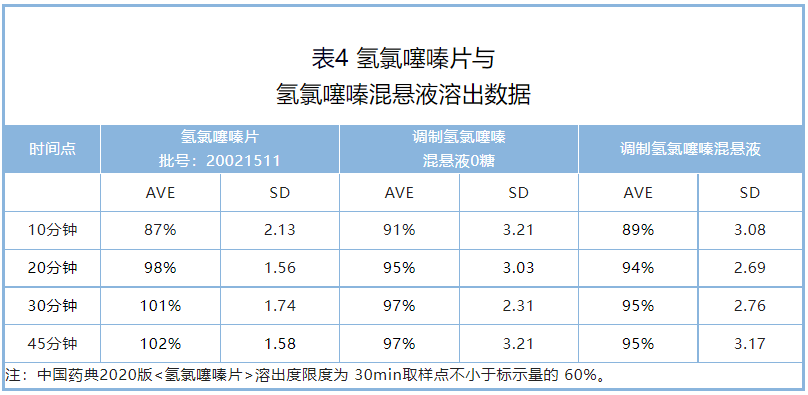
因此,根据溶出曲线比较指导原则,调制氢氯噻嗪混悬液与氢氯噻嗪片具有相似的溶出曲线;且他们30分钟溶出放行点(Q)均大于60%,满足2020年版《中国药典》片剂溶出度标准。
03
/
调制氢氯噻嗪混悬剂
生物等效性风险评估
![1657693899103280A4EC.jpg 640[1].jpg](http://www.liquidmateez.com/upload/at/image/20220713/1657693899103280A4EC.jpg)
文献报道氢氯噻嗪在pH1.0至pH7.4,溶解度为0.6~1.0mg/ml,水中溶解度为0.84mg/ml。
根据生物药剂学分类,WHO将氢氯噻嗪片(规格:25mg)列为BCS III类,属于高溶化合物,体外酸中溶出度显示调制氢氯噻嗪混悬液和氢氯噻嗪片在酸中达到非常快速的释放,在胃液中完全溶解,即氢氯噻嗪片和氢氯噻嗪混悬液进入小肠前已处于完全溶解状态。
氢氯噻嗪的绝对生物利用度为60%~80%,主要吸收部位在十二指肠和空肠上段,体外研究表明,氢氯噻嗪在酸环境或碱环境可能水解,但胃肠道放射性¹⁴C表明,氢氯噻嗪在吸收前未发生降解,故溶解度不是影响吸收的限速步骤。
![1657693917629425EB6C.jpg 640[1].jpg](http://www.liquidmateez.com/upload/at/image/20220713/1657693917629425EB6C.jpg)
有文献报道将氢氯噻嗪片在烧杯中研磨成细粉,加入50毫升水,然后从烧杯中直接给药,通过用水反复洗涤烧杯以确保定量给药,直至摄入240ml,评价其PK数据,数据显示剂量范围25mg~100mg,药动学成线性,且完整的片剂和研磨粉末生物等效,原因是氢氯噻嗪进入小肠前已达到完全溶解状态,不会影响氢氯噻嗪的吸收。
乐宜配所使用辅料在食品和药品中广泛应用,不含有山梨醇,甘露醇,聚乙二醇等影响药物吸收的辅料。综合评价,可以认为,乐宜配调制氢氯噻嗪混悬液与氢氯噻嗪片具有生物等效性。
04
/
小结
![640[1].jpg](http://www.liquidmateez.com/upload/at/image/20220713/1657693947897169609D.jpg)
本文结果显示,乐宜配调制氢氯噻嗪混悬液,含量均匀,室温储存8h或冷藏24h质量稳定,酸中体外溶出曲线与片剂相似,根据对氢氯噻嗪体内吸收特性的评估,可以认为调制氢氯噻嗪混悬液和氢氯噻嗪片具有生物等效性。
乐宜配调制氢氯噻嗪混悬液在临用前由患者家属自行调制,从配制液体中取部分服用,可以达到灵活调整剂量的目的,又可避免药物降解,具有很好的安全性,有效性和方便性。
![1657693985672285F405.jpg 640[1].jpg](http://www.liquidmateez.com/upload/at/image/20220713/1657693985672285F405.jpg)
用乐宜配调制氢氯噻嗪混悬液
可准确的对氢氯噻嗪片进行分剂量
最低分剂量可达1/25
药学研究符合《儿童用药(化学药品)药学开发指导原则》的要求,解决了氢氯噻嗪片分剂量的难题,值得应用推广。
